【Nat.Photon.】洞悉生命“电”活动的新窗口:革命性的细胞成像技术直接进行活细胞内离子通道活性成像
在生命的微观世界里,每一个细胞都像一座繁忙的城市。这座城市的“城门”——分布在细胞膜上的无数个微小蛋白质结构,被称为离子通道——扮演着至关重要的角色。它们精确地控制着带电离子(如钠离子、钾离子、钙离子)进出细胞,如同守门的卫兵。这些离子的流动构成了微弱的生物电流,是神经信号传递、心跳节律、肌肉收缩乃至学习和记忆等几乎所有生命活动的基础。可以说,理解这些“城门”如何以及何时开关,是解开许多生命之谜的关键。
然而,想要亲眼“看”到这些纳米级别的“城门”的开合活动,是一项极其艰巨的挑战。几十年来,科学家们主要依赖两种“侦查”工具,但它们都存在着一个令人两难的“鱼与熊掌不可兼得”的困境。这篇文章所介绍的,正是一种旨在彻底打破这一困境的、名为**电化学调制干涉散射显微镜(EM-iSCAT)**的全新成像技术。它为我们提供了一个前所未有的、能够同时兼顾细节与全局的窗口,去窥探活细胞中离子通道的动态世界。
一、 过去的挑战:在“精”与“广”之间的艰难抉择
在EM-iSCAT技术诞生之前,科学家研究离子通道活动主要面临以下两种方法的局限性:
- 1. 膜片钳技术 (Patch-Clamp):极致的“单点监听”
- 工作方式:这是一种非常经典的电生理学技术。科学家需要用一根比头发丝还细上千倍的玻璃微电极,像一个微型“听诊器”,精准地“吸附”在一小片细胞膜上,甚至只包含一个离子通道。通过这个“听诊器”,可以极其灵敏地记录下单个离子通道开、关时产生的微弱电流变化。
- 优点:它的灵敏度极高,能够捕捉到单个通道的开合细节,是研究离子通道功能无可替代的“金标准”。
- 缺点:它的**“视野”太窄**。这种方法一次只能“监听”一个或极少数几个通道,无法同时观察整个细胞上成千上万个通道的协同工作情况,更不用说观察多个细胞组成的网络了。此外,操作难度极大,且对细胞有一定的物理接触和影响。
- 2. 电压敏感染料成像 (Voltage-Sensitive Imaging):宏观的“活动热图”
- 工作方式:这种方法是给细胞“喂食”一种特殊的荧光染料。当细胞产生电活动时,这些染料会改变其发光强度。通过荧光显微镜,科学家可以观察到整个细胞甚至一片细胞网络的电活动变化,就像看一张动态的“热力图”。
- 优点:它的**“视野”广阔**,能够实现高通量观测,同时看到大量细胞的整体反应。
- 缺点:它的灵敏度不足,无法分辨单个离子通道的活动。它看到的只是一个区域电活动的平均效应,就像在体育场外只能听到模糊的欢呼声,却分不清是哪个观众在呐喊。同时,引入的染料分子本身也可能对细胞的正常生理功能产生干扰。
综上所述,过去的科学家们不得不在“看清一个通道”的高灵敏度和“看全所有细胞”的高通量之间做出痛苦的选择。这极大地限制了我们对复杂生命过程的理解,例如,一个神经元上的不同区域的通道是如何协同工作的?一个细胞群落中的不同细胞在面对相同刺激时为何反应各异?
二、 革命性突破:EM-iSCAT技术的工作原理
这篇论文的核心,就是介绍了一种全新的、巧妙的成像方法——EM-iSCAT,它完美地融合了高灵敏度与高通量的优点,并且还实现了**“无标记”**观测,即无需任何染料。
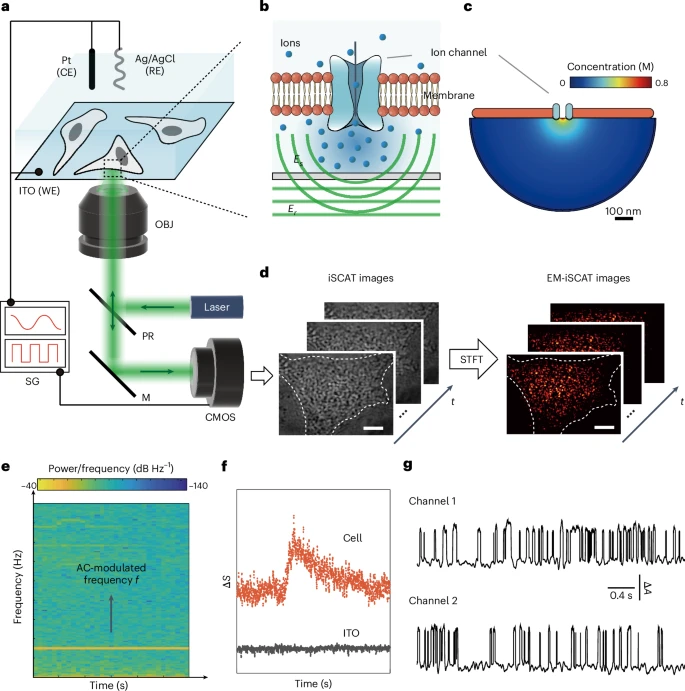
我们可以把这个技术的名字拆解开来理解:
- 核心技术:iSCAT (干涉散射显微镜)
- 想象一下,在一个平静的湖面上,即便是一粒微小的尘埃落下,也会激起一圈极其微弱的涟漪。iSCAT技术就像一台超级灵敏的“涟漪探测器”。它向细胞照射一束激光,当光线遇到细胞上像离子通道这样的纳米级结构时,会发生极其微弱的散射,就像光被这些微小物体“弹开”了。
- 这个散射信号本身非常微弱,几乎淹没在背景光中。iSCAT的精妙之处在于它利用了光的“干涉”原理——它将散射回来的微弱光波与一部分原始的参考光波叠加。通过精巧的设计,这种叠加能够极大地放大那个微弱的散射信号,从而让原本看不见的单个蛋白质分子、病毒颗粒等变得清晰可见。最重要的是,这个过程完全不需要荧光标记。
- 点睛之笔:EM (电化学调制)
- 仅仅有iSCAT还不足以看到离子通道的“活动”。因为细胞本身就是一个复杂的结构,iSCAT会看到细胞膜上所有的静态结构,我们无法从中分辨出哪个信号是来自离子流动的。
- 为此,研究者们加入了一个绝妙的设计:他们通过一个微电极系统,对整个样品施加一个微弱的、以特定频率(例如,每秒30次或150次)来回振荡的电场。这个电场非常温和,并不会干扰细胞的正常生命活动。
- 这个“调制电场”就像给离子活动打上了一个独特的“节拍器”。当一个离子通道打开,带电离子涌出,在通道口形成一小团“离子云”。这团“离子云”的浓度会随着外部施加的电场而同步振荡。
- 如此一来,由这团“离子云”产生的iSCAT信号,就会带上与电场完全相同的振荡频率。而细胞的其他静态结构产生的信号则没有这个频率特征。
- 智能“解码”:信号处理
- 最后,计算机对显微镜拍摄的连续图像(视频)的每一个像素点进行一种名为“傅里叶变换”的数学分析。这个过程就像收音机调频,计算机被设定为只“收听”那个被电场“标记”了的特定频率。
- 通过这种方式,所有来自细胞静态结构的背景噪声都被完美滤除,只有那些与电场同步振荡的、由离子流动产生的信号被提取并放大出来。最终生成的EM-iSCAT图像,不再是细胞的形态图,而是一张动态的**“电活动地图”**,图上的每一个亮点,都代表着一个正在活跃的离子通道或通道集群。
三、 EM-iSCAT的强大能力:实验结果展示
这篇论文通过一系列精彩的实验,全方位展示了EM-iSCAT技术的强大功能:
- 1. 兼具“全景”与“特写”的双模式观测
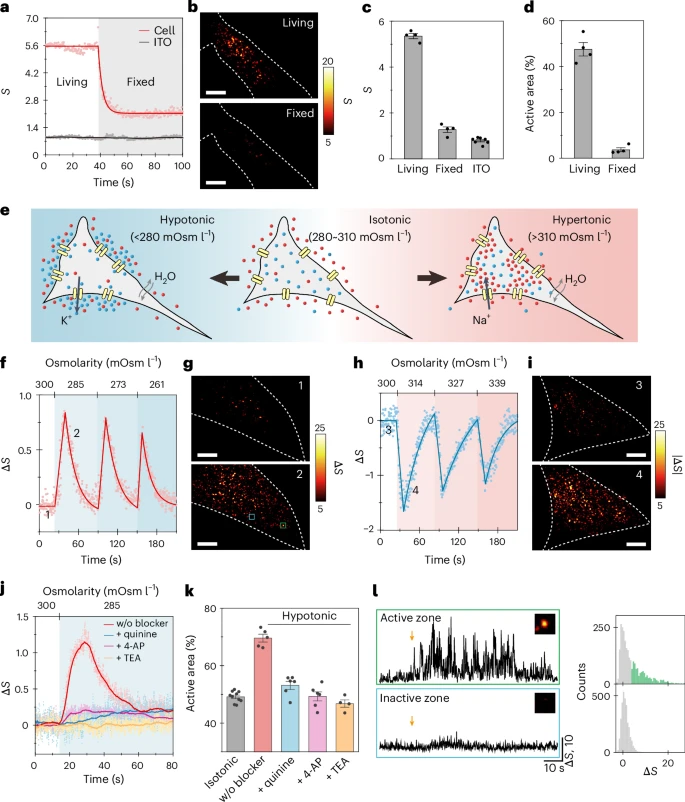
- 全细胞模式(宏观视角):研究者将细胞置于不同“咸度”(渗透压)的溶液中。当外部溶液变“淡”时,细胞为了维持内外平衡,会大量打开离子通道向外排出离子。在EM-iSCAT的视野下,可以清晰地看到整个细胞膜上的“亮点”(即活跃区域)数量急剧增加。反之亦然。当用药物堵住这些通道后,这种响应就消失了,这有力地证明了信号确实来源于离子通道的活动。
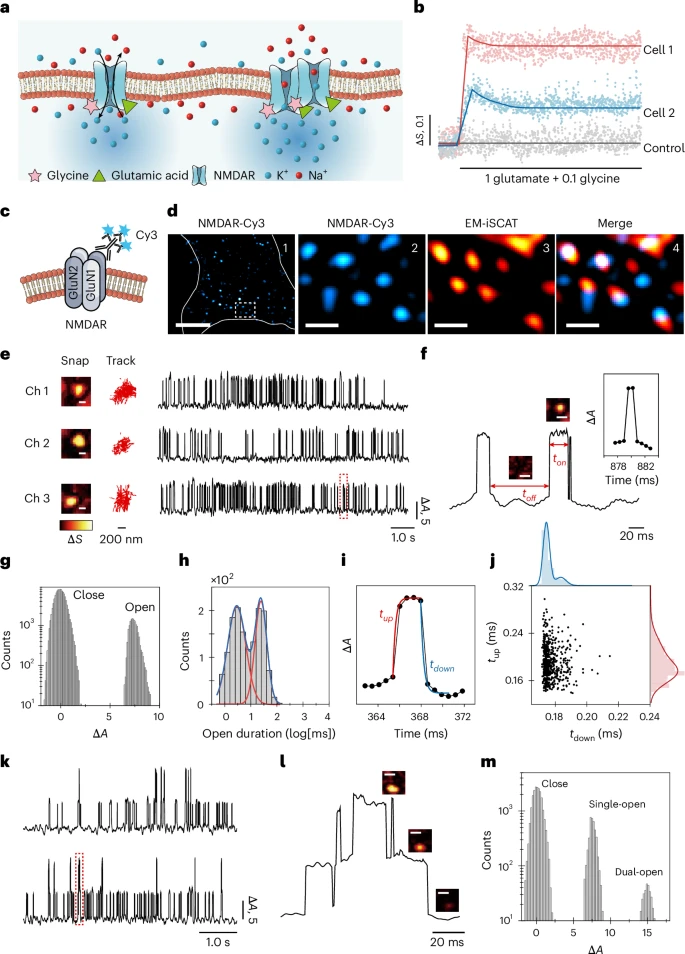
- 单通道模式(微观细节):这是该技术最令人振奋的能力。研究者成功地对一种对学习和记忆至关重要的“NMDAR”离子通道进行了观测。他们不仅能清晰地看到单个NMDAR通道像灯泡一样“开启”(出现亮点)和“关闭”(亮点消失)的完整过程,其记录到的开闭节律、持续时间等数据与经典的膜片钳技术测量结果高度吻合。更神奇的是,EM-iSCAT还能以每秒1500帧的超高速度,追踪单个离子通道蛋白在流动的细胞膜上进行的微小“漂移运动”,这为研究通道所处的微环境提供了宝贵信息。
- 2. 无需标记,即可“指认”和“定位”不同类型的通道
- 这是一个极具开创性的应用。研究者通过巧妙地改变细胞外液中特定离子的浓度(例如,分别富集钾离子、钠离子或钙离子),来特异性地“激活”对这些离子敏感的通道。
- 结果发现,在富钾、富钠、富钙的环境下,细胞膜上被点亮的“活动地图”是截然不同的,亮点的分布区域各不相同。这表明,EM-iSCAT可以在不使用任何标签的情况下,仅通过分析通道对不同离子的响应模式,就能区分出细胞膜上不同种类的离子通道,并绘制出它们的空间分布图。
- 3. 区分“单兵作战”与“团队协作”的通道
- 在生物体内,离子通道有时会聚集在一起形成“通道簇”协同工作。EM-iSCAT能够轻易地分辨出这种差异。单个通道打开时,信号只有一个亮度等级;而当两个通道组成的“簇”同时打开时,信号亮度会翻倍,呈现出阶梯状的变化。论文中,研究者通过观察尼古丁受体(一种离子通道)的活动,清晰地记录到了这种单个通道和通道簇的不同信号特征。
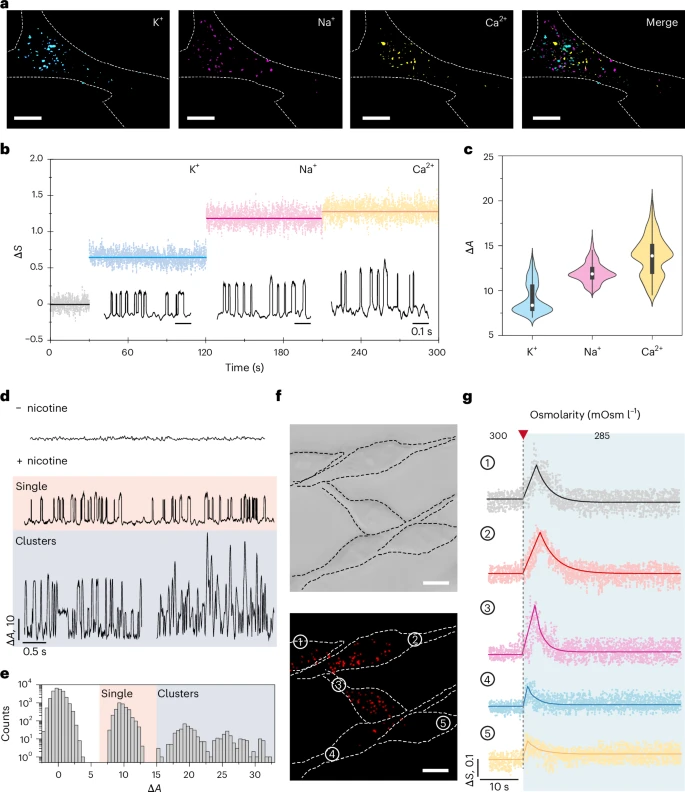
- 4. 同时监测细胞“社区”中的个体差异
- 凭借其高通量的优势,EM-iSCAT可以同时监测一个细胞网络中的多个细胞。在实验中,研究者同时观察了5个细胞在受到相同刺激时的反应。结果发现,每个细胞的响应强度和速度都存在细微的差异。这种“异质性”在生命活动中普遍存在且意义重大,而EM-iSCAT为研究这种现象提供了强有力的工具。
四、 总结:开启神经科学与细胞生物学研究的新篇章
EM-iSCAT技术的诞生,标志着光学电生理学领域的一项重大进步。它一举克服了传统方法长久以来的核心矛盾,集无标记(无干扰)、单通道级的高灵敏度和多细胞级的高通量三大优势于一身。
这篇文章的深远意义在于:
- 提供了一个全新的研究范式:科学家们终于可以像看一部高清电影一样,实时、直观地观察活细胞上成千上万个离子通道是如何“编排”复杂的生命交响乐的。这对于揭示神经信号处理、药物作用机制、以及癫痫、心律失常等离子通道相关疾病的机理具有不可估量的价值。
- 降低了研究门槛:相比于操作极其困难的膜片钳技术,EM-iSCAT的信号直接从图像中提取,对操作者的要求大大降低,并且有潜力发展成自动化、智能化的集成设备。
- 未来的无限可能:研究者展望,未来该技术还可以与人工智能相结合,通过学习不同通道的信号“指纹”,实现对通道类型的自动识别。更有可能发展出三维成像能力,去探索细胞更复杂的立体结构上,乃至细胞内部细胞器上的离子通道活动。
总而言之,EM-iSCAT技术为我们打开了一扇观察生命电活动的新大门。它所带来的不仅仅是一项工具的革新,更有可能催生一系列颠覆性的科学发现,让我们对生命最核心的奥秘有更深层次的理解。
参考文献
Li, QY., Lyu, PT., Kang, B. et al. Electrochemically modulated interferometric scattering microscopy for imaging ion channel activity in live cells. Nat. Photon. (2025). https://doi.org/10.1038/s41566-025-01696-z